Рекомендации по лечению актинического кератоза
Вступление от Д.С.: Специально для вас перевёл статью о лечении актинического кератоза. Наиболее свежие методы с доказанной эффективностью собраны ниже. Сложные моменты связанные со статистикой я намеренно упразднил, добавил несколько фото актинического кератоза из своей практики. Пожалуйста, обратите внимание – эта статья носит информационный характер и не является руководством для самолечения. Устанавливать диагноз и назначать лечение должен врач. Оригинал статьи здесь https://www.jaad.org/article/S0190-9622(21)00502-8/fulltext
Daniel B. Eisen, врач,
Maryam M. Asgari, врач, магистр здравоохранения,
Daniel D. Bennett, врач,
Suzanne M. Connolly, врач,
Robert P. Dellavalle, врач, кандидат наук, магистр здравоохранения,
Esther E. Freeman, врач, кандидат наук,
Gary Goldenberg, врач,
David J. Leffell, врач,
Sue Peschin, магистр здравоохранения,
James E. Sligh, врач, кандидат наук,
Peggy A. Wu, врач, магистр здравоохранения,
Lindsy Frazer-Green, кандидат наук,
Sameer Malik, врач, магистр бизнес-администрирования,
Todd E. Schlesinger, врач
Актинический кератоз (АК) – одно из наиболее распространенных патологических состояний, которые диагностируют и лечат американские дерматологи[1]. Эти рекомендации представляют интерес непосредственно для пациентов, дерматологов и других специалистов, занимающихся лечением АК. Предраковые новообразования на неороговевшем эпителии, такие как актинический хейлит, не рассматриваются.
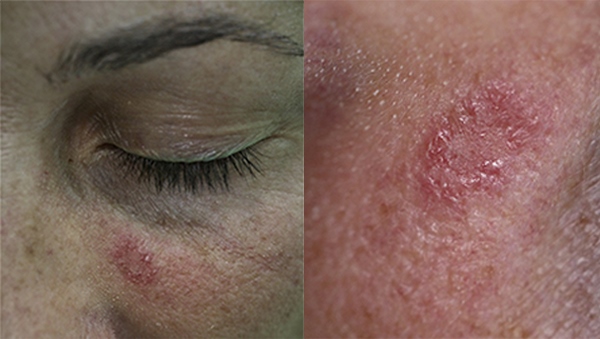
Клиническая картина актинического кератоза (Прим. Д.С.:)
Чаще всего, очаг себорейного кератоза располагается на лице и выглядит как красноватое пятно, не выступающее над уровнем кожи или выступающее минимально.
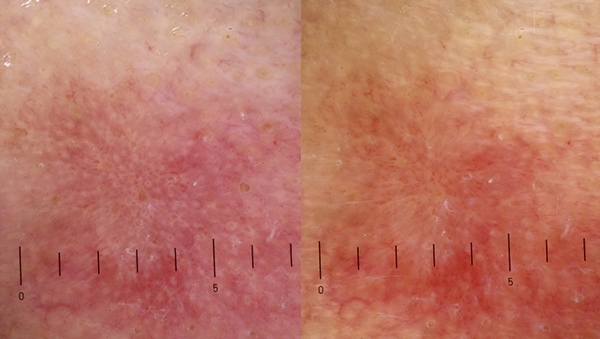
Дерматоскопическая картина актинического кератоза редко представляет сложности для диагностики (авторы статьи напишут об этом ниже).
На фоне однородной эритемы отмечается подчеркнутый рисунок волосяных фолликулов, которые вместе образуют «клубничный» паттерн – рисунок, напоминающий поверхность всем известной ягоды:
В этой статье речь пойдет о разных методах лечения АК, включая местную терапию, криохирургию и фотодинамическую терапию (ФДТ). Для получения объективной картины авторы начинают с клинических характеристик, гистологической классификации, течения болезни в отсутствие лечения, риска прогрессирования и принципов дерматологического наблюдения актинического кератоза.
Суть исследования
Мультидисциплинарная рабочая группа представила систематизированный обзор, отвечающий на 5 клинических вопросов:
- Каковы эффективность, результативность и побочные эффекты хирургического и химического лечения АК?
- Каковы эффективность, результативность и побочные эффекты местных средств для лечения АК?
- Каковы эффективность, результативность и побочные эффекты аппаратных и им подобных методов лечения АК?
- Каковы эффективность, результативность и побочные эффекты комбинированной терапии АК?
- Каковы специфические условия лечения АК у больных с ослабленным иммунитетом?
Эффективность оценивалась по показателям, которые получают в идеальных и контролируемых условиях, результативность же – в реальных условиях[2].
Определение и клинические характеристики
Актинический кератоз – это новообразование из кератиноцитов (эпителиальная опухоль), возникающее на коже после длительного воздействия ультрафиолетового излучения[4]. Традиционно оно описывается, как грубая чешуйчатая папула на эритематозной основе, которая развивается в зонах, анатомически подверженных УФ-воздействию.
В клинической практике возможны разные варианты его проявления (табл. 1):
Таблица 1. Клинические проявления актинического кератоза
|
Критерий |
Варианты |
|
Степень эпидермального гиперкератоза |
в диапазоне от атрофического до глубоко гипертрофического (гиперкератотического), включая те, что вызывают ороговение |
|
Визуальные проявления |
пигментные или бовеноидные[5] |
|
Мягкость (шкала Олсена) |
I степень – мягкие и тонкие, определяемые только наощупь; II степень – умеренные, выявляемые при тщательной пальпации; III степень – очень толстые, легко ощутимые[6]. |
Однако эти классификации чаще используются для исследовательских целей и в клинической практике, как правило, не применяются.
Гистологическая классификация
С точки зрения гистологии, актинический кератоз характеризуется эпидермальной гиперплазией с разными степенями клеточной атипии. От плоскоклеточного рака (в его первоначальной локализации) его отличает отсутствие эпидермальной атипии по всей толщине эпидермиса[7].(Прим. Д.С.: эпидермис – самый верхний слой кожи. Его толщина на лице не более 0.5мм. Актинический кератоз локализован только в эпидермисе и глубже не проникает)
АК иногда сопровождается воспалением и связанным с ним дискомфортом. В зависимости от чувствительности пациента, дискомфорт может отсутствовать вовсе или быть невыносимым [10].
Боль может ассоциироваться с АК, но также она может быть симптомом плоскоклеточного рака, поэтому диагностика должна проводиться предельно внимательно[11],[12].
Молекулярные данные о развитии АК дают основания полагать, что многие присущие ему клеточные изменения встречаются и при плоскоклеточном раке. Это позволяет классифицировать его как предраковый процесс.[17].
Хотя для диагностики АК биопсия обычно не требуется, гистологическое исследование может обеспечить оценку степени тяжести заболевания. Основная гистологическая классификация фокусируется на сходстве АК и плоскоклеточного рака, дополнительно оценивают также клинические и дерматоскопические данные[20] (табл. 2):
Таблица 2. Классификации по степени тяжести актинического кератоза
|
Критерий |
Степени тяжести |
|
Глубина поражения эпидермиса (шкала Роуэрта-Хубера) |
I степень – базальный и надбазальный слои; II степень – две трети; III степень – более двух третей, с захватом потовых желез и волосяных фолликулов. |
|
Степень атипии кератиноцитов (шкала Кокерелла) |
I степень – плоская макула без гиперкератоза, атипия в нижней трети эпидермиса; II степень – гиперкератотическая папула с переменными уплотнениями. Атипия в нижних двух третях; III степень – твердые бляшки, атипия по всему эпидермису. |
|
Пролиферация (шкала Голдберга) |
Пролиферативные папулы; Непролиферативные папулы. |
В настоящее время нет какого-либо золотого стандарта классификации, и сопутствующие исследования вскрыли необходимость корректировки имеющихся систем[23].
Течение заболевания без лечения
Актинические кератозы обычно не проявляются в первые 10 лет жизни, если у конкретного человека нет генетической предрасположенности к усиленному повреждению кожи под действием УФ-излучения или к этому не располагает окружающая среда.
Для АК типично проявление в зонах, наиболее подверженных негативному воздействию солнечных лучей у светлокожих людей.
Вследствие максимального воздействия солнца больше всего страдают голова, уши, шея, плечи, руки и ноги. АК нередко может развиваться на коже головы, особенно в местах выпадения волос [24],[25],[26].
Хотя актинический кератоз - хроническое заболевание кожи, если его не лечить, он может спонтанно разрастаться или, что более важно, превращаться в карциному из кератиноцитов (эпителиальную опухоль, она же – плоскоклеточный рак кожи)[33]. Прежде всего, это касается пациентов:
- имеющих в анамнезе рак кожи;
- преклонного возраста;
- со сниженным иммунитетом;
- с другими факторами, предрасполагающими к более высокой скорости прогрессирования заболеваний.
Таким образом, АК выступает индикатором риска развития рака кожи. В свою очередь, успешное лечение АК снижает риск развития плоскоклеточной карциномы[34].
Прогрессирование и озлокачествление
На молекулярном уровне гиперплазию кератиноцитов, вызванную АК, обусловливают приобретенные соматические мутации в ДНК кератиноцитов, индуцированные УФ-мутагенезом[35].
Следы ДНК-мутаций включают в себя C-T и CC-TT изменения, которые традиционно рассматриваются во взаимосвязи:
- с прямым повреждением ДНК волнами ультрафиолета средней длины (UVB);
- с мутациями в целом, которые с большей вероятностью вызваны эндогенным старением клеток под действием активных форм кислорода[37].
Специфические мутации ДНК, связываемые с актиническим кератозом, включают и те, что наблюдаются при карциноме из кератиноцитов, в том числе мутации в гене TP53, кодирующем белок р53, известный своей ролью в подавлении роста опухолей для предотвращения их дальнейшего озлокачествления[39].
В число дополнительных мутаций, которые считаются патогенными при развитии АК, включены также мутации в:
- p16;
- генах семейства Ras;
- NFKB;
- CDKN2A;
- теломеразе;
- TNF альфа[45].
Оценки риска прогрессирования актинического кератоза до плоскоклеточного рака варьируются в пределах от менее чем 0,1 % до 20 %[49]. Ограниченный объем данных исследований затрудняет точное прогнозирование течения АК.
Из исследований, в рамках которых изучался с гистологической точки зрения плоскоклеточный рак, известно, что АК сопутствовал ему в 60 % случаев[54].
Лечение
Варианты лечения актинического кератоза, имеющиеся в арсенале медиков на сегодняшний день, включают:
- кремы для местного применения;
- гели и растворы;
- криохирургию;
- фотодинамическую терапию (ФДТ).
Выбор метода основывается на особенностях течения заболевания (например, место локализации), факторах, связанных непосредственно с самим методом (эффективность, переносимость, нагрузка на организм), а также характеристиках и личных предпочтениях пациента.
Внимание пациента обычно сосредоточено на:
- сопутствующих симптомах;
- риске прогрессирования до карциномы из кератиноцитов;
- переносимости;
- нагрузке, которую дает лечение на организм;
- внешнем виде до, во время и после лечения АК[55].
Хотя настоящие рекомендации и посвящены лечению АК, есть ситуации, когда можно обойтись и без него. Например, можно сократить наблюдение за пациентами с ограниченной продолжительностью жизни, а также в случае, если болезненность лечения перевешивает его потенциальные эффект[58].
Поскольку степень вовлечения пациента в процесс лечения и диапазон дискомфорта варьируются в зависимости от условий терапии, важно, чтобы врач и пациент совместно принимали решение о выборе метода. В этом решении должны быть учтены:
- привычки пациента по соблюдению предписаний врача;
- способность переносить ожидаемые местные кожные реакции или дискомфорт;
- предпочтительная продолжительность терапии;
- соотношение последствий для здоровья и прогнозируемой вероятности успешного исхода.
Лечение актинического кератоза может быть направлено на место его зарождения или на «поля канцеризации» (Прим. Д.С.: это участки фотоповрежденённой кожи по периферии актинического кератоза). В первом случае могут использоваться местные средства или ФДТ для контроля изменений кератиноцитов. Их преимущества – снижение риска развития новых очагов АК, ограничение его разрастания и смягчение последствий, клинически не проявляющихся[59].
Во втором случае контролируются несколько областей поражения АК, в том числе изолированных. Применяются индивидуальные методы лечения, проведение которого возможно только в кабинете врача: физические (криохирургия с жидким азотом) или деструктивные (кюретаж). Лечение может завершиться за одно посещение, в дальнейшем пациент только ухаживает за участком кожи, который подвергался процедуре.
На практике существуют ограничения по количеству пораженных зон, при котором можно использовать такие методы лечения. При его превышении из-за потенциального дискомфорта, причиняемого пациенту, и возможных нежелательных последствий очаговое лечение становится более предпочтительным.
УФ-защита
Рандомизированные контролируемые исследования показали, что использование солнцезащитного крема для предотвращения воздействия УФ-излучения незначительно снижает заболеваемость актиническим кератозами и уменьшает количество появляющихся новых очагов[61].
Исследования, посвященные применению проводящих или солнцезащитных кремов (коэффициент защиты от солнца – 17) на протяжении 6 месяцев, выявили, что у людей, использовавших солнцезащитный крем, меньше случаев АК (соотношение = 0,62) и более высокие шансы ремиссии на начальной стадии (отношение шансов = 1,53)[62].
Также сообщается, что по результатам двухлетнего наблюдения частота заболеваемости АК у людей, ежедневно использующих солнцезащитный крем (1,20), ниже, чем у тех, кто применяет его от случая к случаю (1,57).
Эти результаты свидетельствуют о снижении частоты АК при использовании солнцезащитного крема на 24 %. Поэтому рабочая группа настоятельно рекомендует его как надлежащий способ минимизации УФ-воздействия[63].
При этом защита должна быть комплексной: избегать следует природных и искусственных источников УФ-лучей (Прим. Д.С.: здесь, пользуясь случаем, передаю привет любителям солярия); использовать непроницаемую одежду с маркировкой UPF и солнцезащитный крем, блокирующие волны ультрафиолета разной длины (как UVA, так и UVB).
Местные средства
Использование местных кремов, гелей и растворов для лечения актинического кератоза достаточно распространено в дерматологической практике. Местные средства могут применяться точечно или на широких поверхностях, они особенно эффективны, когда АК появляется в зонах с высокой плотностью или имеет нечеткие границы.
Назначаемые местные средства всегда несут риск возникновения локальных кожных реакций. Если из-за такой кожной реакции приходится прекращать лечение без достижения желаемого терапевтического эффекта, врачу необходимо разработать для пациента индивидуальную программу лечения, которая поможет достичь намеченных результатов.
В литературе, посвященной лечению АК, настоятельно рекомендуют для очагового лечения 5-фторурацил или имиквимод. Схемы лечения отличаются по концентрации, интервалу дозирования и продолжительности применения.
Рабочая группа условно рекомендует диклофенак, поскольку качество доказательной базы по нему ниже, чем по 5-фторурацилу или имиквимоду.
В рамках систематического обзора было обнаружено несколько небольших исследований, непосредственно посвященных сравнению эффективности и безопасности различных местных препаратов для лечения АК[69]. Члены рабочей группы считают, что их результатов недостаточно для формирования рекомендаций по сравнительной эффективности и безопасности местной терапии.
Криохирургия
Проспективные исследования и сравнительные испытания предоставили убедительные доказательства того, что криохирургия – это легкодоступный, быстрый и эффективный метод лечения областей поражения актиническим кератозом. Клинически подтверждено, что этот метод позволяет победить АК, наблюдавшийся в период от 3 месяцев до 8,5 лет, в 57-98,8 % случаев[74].
Скорость излечения варьируется в зависимости от продолжительности замораживания. Данные проспективного многоаспектного исследования спрея с жидким азотом для лечения АК на лице и коже головы представлены в таблице 3.
Таблица 3. Частота выздоровления в зависимости от продолжительности замораживания
|
Частота выздоровления |
Продолжительность замораживания |
|
39 % |
менее 5 секунд |
|
69 % |
5-20 секунд |
|
83 % |
более 20 секунд[75] |
Рабочая группа настоятельно рекомендует криохирургию в качестве надлежащего подхода к лечению актинического кератоза. Основные риски процедуры – дискомфорт во время лечения и дисхромия после него. Но они, как правило, минимизируются при более короткой продолжительности замораживания, хотя это и может снизить общий уровень ответа на лечение.
Лазерная абляция тоже является деструктивным методом лечения АК, но он не так широко доступен в дерматологических кабинетах, как криодеструкция.
Сравнительное исследование лазерной шлифовки и криохирургии для лечения актинического кератоза на лице и коже головы показало, что криохирургия дает более предпочтительные результаты в обеих зонах и полное очищение кожи[76].
Через 3 месяца после лечения криохирургическим методом в 78,2 % случаев не осталось следов от АК на начальной стадии (у лазерной абляции этот показатель составил 72,4 %). Полное выздоровление отмечалось в 71,6 % случаев после криохирургической обработки и в 65,3 % случаев – после лазерного лечения.
Хотя нежелательные явления систематически не рассматривались, рейтинги удовлетворенности пациентов указывают на предпочтительность криохирургии по отношению к лазерному лечению. Рабочая группа условно рекомендует данный метод, и эта рекомендация подкрепляется доказательствами среднего качества.
Фотодинамическая терапия
ФДТ – привлекательная платформа для лечения актинических кератозов. Процедура проводится только на профессиональной аппаратуре в кабинете врача. Она способна увеличить эффективность других методов лечения, которые пациенты применяют на дому. Протоколы ФДТ в США основаны на коммерческой доступности фотосенсибилизирующего комплекса в сочетании с различными источники света.
Протоколы и продолжительность лечения варьируются, поскольку фотосенсибилизирующий комплекс может проявляться моментально или после часового воздействия источником света[77],[78],[79],[80],[81],[82].
Во многих литературных источниках предлагается лечить АК методом ФДТ с метиламинолевулинатом в качестве фотосенсибилизирующего комплекса, который работает с разными источниками энергии, или ФДТ в сочетании с местными средствами. наносимыми перед активацией красным светом[94]. Поскольку этот комплекс недоступен в США, рабочая группа исключила МАЛ-ФДТ из рассмотрения и последующих рекомендаций.
ФДТ с АЛК под красным светом
Основной сенсибилизирующий агент для протоколов ФДТ в США – это 5-аминолевулиновая кислота (АЛК). Отвечая на вопрос, является ли ФДТ с АЛК под красным светом эффективной для избавления от актинического кератоза и предотвращения развития карциномы из кератиноцитов, рабочая группа изучила данные четырех исследований, где использовался сенсибилизирующий агент в форме 10 % геля АЛК (78 мг/г наноэмульсии АЛК)[98]. Они сообщают, что ФДТ с АЛК под красным светом более эффективна, чем плацебо под красным светом для уменьшения зоны поражения, полного излечения АК и профилактики развития карциномы. Частота редукции поражения после 12-недельного курса лечения составляет 89,1 % и 32,7 % соответственно, полного излечения – 77,1 % и 16,6 % соответственно.
Дополнительное исследование, посвященное долгосрочному наблюдению за пациентами, получавшими ФДТ с АЛК и плацебо-терапию, показало, что через 12 месяцев после лечения рак диагностировали у 3,6 % участников первой группы и 5,0 % – второй группы[100].
Рабочая группа, рассмотрев данные об эффективности, выявила существенное преимущество ФДТ с АЛК под красным светом для лечения актинического кератоза, а, рассмотрев данные о рисках раздражения кожи, боли и последующих косметических операций, пришла к выводу о минимальном возможном вреде этого метода. Однако в целом суммарное качество этих доказательств – низкое, поэтому рабочая группа условно рекомендует ФДТ с АЛК под красным светом для лечения актинического кератоза.
ФДТ с АЛК под дневным светом
Протоколы ФДТ дневного света предполагают использование природного солнечного света в качестве энергетического ресурса для активации сенсибилизирующего препарата. В рамках исследования сравнивались эффективность и болезненность лечения, повторяемого каждые 2 недели по 3 сеанса, методами ФДТ с АЛК под красным светом и ФДТ с АЛК под дневным светом с 2-часовым воздействием[101].
Результативность обоих методов лечения оказалась существенной: поражение уменьшилось на 96 % с применением дневного света и на 97 % – красного. Вред, наносимый лечением ФДТ с АЛК, в целом невысок, но показатель болезненности выше у тех пациентов, кто проходил терапию с красным светом. По 11-балльной шкале, где 0 – это отсутствие боли, а 10 – нестерпимая, пациенты, получавшие обычную ФДТ (с красным светом), в среднем оценили боль в 5,2 ± 1,7 балла, а участники группы, где использовался дневной свет, – в 1,7 ± 0,9 балла.
Таким образом, рабочая группа условно рекомендует ФДТ с АЛК под дневным светом как менее болезненный, но такой же эффективный, как ФДТ с АЛК под красным светом, метод лечения актинического кератоза.
ФДТ с АЛК под синим светом
ФДТ с АЛК под синим светом показала внушительные преимущества по сравнению с плацебо под синим светом с точки зрения достижения полного или частичного выздоровления, редукции поражения и профилактики развития карциномы[104].
Объединенные данные свидетельствуют о том, что на 8 неделе курса ФДТ с АЛК под синим светом устраняется 82,2 % поражения, тогда как при использовании плацебо под синим светом – только 28,8 %[106].
Дополнительное исследование сообщает, что через 8 недель после одного курса лечения АК методом ФДТ с АЛК под синим светом полное или частичное выздоровление достигается у большего числа пациентов, чем после плацебо под синим светом[108].
По итогам 24-недельного наблюдения, доля пациентов, у которых развилась карцинома из кератиноцитов в зонах, подвергнутых ФДТ с АЛК под синим светом, была меньше, чем у пациентов, получавших плацебо под синим светом, но разница не является статистически значимой[109].
Вред, наносимый пациентам лечением, оценивается как минимальный и выражается преимущественно в эритеме, отеках, образовании язв и жжении в зоне воздействия. Значительно больше пациентов, проходивших ФДТ с АЛК под синим светом, сообщили о изъязвлении или жжении по сравнению с теми, кого лечили плацебо под синим светом (88,3 % против 13,0 %).
Эти результаты подтверждают также данные рандомизированных контролируемых исследований, в рамках которых сравнивалось лечение актинического кератоза верхних конечностей методом ФДТ с АЛК под синим светом с ФДТ с проводящим средством под синим светом. Через 12 недель 31 % участников (42 из 135), проходившие ФДТ с АЛК, полностью выздоровели, тогда как во второй группе таковых было 13 % (17 из 134)[110].
Рабочая группа условно рекомендует ФДТ с АЛК под синим светом в качестве метода лечения актинического кератоза, основываясь на доказательствах умеренного качества.
Есть доказательства того, что нагревание кожи с помощью электрогрелки во время лечения с применением АЛК, может усилить редукцию актинического кератоза. Однако еще предстоит уточнить конкретные тепловые параметры, прежде чем давать какие-либо рекомендации по нагреванию кожи[112].
Комбинированная терапия
В ходе систематического обзора доказательных данных было обнаружено несколько исследований, в рамках которых для лечения актинического кератоза использовалась комбинированная терапия. В этих испытаниях придерживались последовательного подхода к комбинированной терапии, когда лечение местными средствами предшествует или следует за другим методом лечения с целью максимизировать ответ на него.
По результатам сравнительных исследований, оценивавших применение для лечения АК местных медикаментов в сочетании с криохирургией, были выведены 5 рекомендаций, из которых 3 условно поддерживают использование комбинированной терапии, а 2 одобряют одну только криотерапию.
Дополнительный условный аргумент против применения комбинированной терапии подкрепляется исследованием последовательного проведения ФДТ с АЛК под синим светом и имиквимода местно.
5-фторурацил и криохирургия
В двух исследованиях оценивалось совместное использование для лечения АК 5-фторурацила и криохирургии[114]. В их рамках сравнивались результаты курсов предварительного лечения продолжительностью в 1 неделю.
В первом применялся крем с 0,5 % концентрацией 5-фторурацила совместно с криохирургией, во втором – проводящий крем до криохирургии[115]. Преимущества первого оказались незначительными, а при повторении циклов комбинированной терапии они и вовсе приобретали тенденцию к рассеиванию.
Эти исследования сообщают о незначительных различиях в побочных эффектах после первого цикла комбинированной терапии (хотя локальные кожные реакции ухудшались в последующих циклах у пациентов из группы, где применяли 5-фторурацил).
На основе этих доказательств умеренного качества, дающих основания полагать, что степень поражения уменьшается, а побочные эффекты не усиливаются, комбинация крема 5-фторурацила в сочетании с криохирургией рекомендуется условно.
Имиквимод и криохирургия
В других исследованиях сравнивались результаты применения после криохирургии имиквимода в концентрации 3,75 % или 5 % и проводящего крема[118]. Эффективность комбинированной терапии оценивали по показателям полного излечения, уменьшения площади поражения и внешнего вида. Все результаты говорили о преимуществах комбинированной терапии по сравнению с одной только криохирургией:
- Через 22 недели после лечения у пациентов, получавших 5 % имиквимод в сочетании с криохирургией, показатель полного выздоровления составил 22,6 %, у участников группы с проводящим кремом – 9,4 %.
- Через 26 недель после лечения у пациентов, получавших 3,75 % имиквимод в сочетании с криохирургией, показатель полного выздоровления составил 30,2 %, у участников группы с проводящим кремом – 3,3 %.
Что касается степени вреда, наносимого лечением, то здесь была замечена умеренная разница. У участников, проходивших комбинированную терапию, частота возникновения локализованных кожных реакций и других побочных эффектов была выше.
В целом рабочая группа считает, что преимущества сочетания имиквимода с криохирургией перевешивают возможный вред. Таким образом, оно рекомендуется условно, поскольку выводы основаны на доказательствах низкого качества.
Имиквимод и ФДТ с АЛК под синим светом
Для изучения эффектов добавления 5 % имиквимода местно в схему лечения актинического кератоза лицо делилось на 2 части. На одну сторону наносился проводящий крем, на противоположную – 5 % имиквимод[119]. Лечение проводилось дважды в неделю на протяжении 16 недель, начиная со второго месяца после двух циклов ФДТ с АЛК под синим светом.
В целом на стороне, где проводилось лечение имиквимодом, наблюдалось небольшое по площади, но значительное заживление пораженных участков. Изначально средний процент поражения составлял 23,5 % на стороне, обрабатываемой имиквимодом, и 21,5 % – на стороне, обрабатываемой проводящим кремом. Через 12 месяцев после лечения в среднем редукция поражения составила 89,9 % и 74,5 % соответственно.
Тем не менее в аспекте полного выздоровления разницы не было (8,3 % случаев с обеих сторон). О разнице в побочных эффектах не сообщалось. Рабочая группа, основываясь на этих доказательствах умеренного качества, условно рекомендует применение имиквимода после ФДТ с АЛК под синим светом.
Слабые стороны исследования
Пациенты с ослабленным иммунитетом
Один из клинических вопросов, поднятый рабочей группой в начале разработки настоящих рекомендаций, – есть ли специфика лечения актинического кератоза у людей с ослабленным иммунитетом. Часто у таких пациентов наблюдается более выраженная или комплексная симптоматика, и у них повышен риск развития злокачественных кожных новообразований, в частности плоскоклеточного рака[121].
Отсутствие доказательной базы не позволило сформулировать рекомендации по лечению АК для этой группы пациентов.
Столь высокого уровня качества доказательств, какой требуется от более крупных рандомизированных контролируемых испытаний, трудно достичь в ситуации, когда популяция пациентов ограничена очень специфичной подгруппой, например, больных с хронической лимфоцитарной лейкемией или пересаженными органами.
В этом случае высококачественные результаты наблюдений могут помочь в принятии терапевтических решений, если они подкреплены доказательствами, но выходят за рамки данного руководства.
Профилактика карциномы из кератиноцитов
Несмотря на наличие убедительного теоретического обоснования того, что лечение актинического кератоза предотвращает развитие рака кожи, немногие из исследований, включенных в настоящий обзор, используют заболеваемость раком кожи в качестве показателя результативности лечения АК. Кроме того, продолжительность наблюдений в рамках этих исследований недостаточна для оценки развития карциномы.
Рабочая группа отметила заболеваемость раком в качестве вопроса, представляющего интерес. Отсутствие доказательной базы по нему может указывать, что данный обзор фокусировался на лечении актинического кератоза, а не профилактике рака кожи.
Недавно опубликованные результаты анализа объединенных данных двух рандомизированных испытаний, в рамках которых сравнивалась эффективность лечения АК лица 5 % имиквимодом и 3 % диклофенаком, указали на гистологическое прогрессирование актинического кератоза до инвазивного плоскоклеточного рака через 36 месяцев после лечения. Такое прогрессирование наблюдалось у 4 из 242 (1,7 %) пациентов, получавших имиквимод, и у 7 из 237 (3,0 %) пациентов, которых лечили диклофенаком[122].
Масштабное рандомизированное контролируемое исследование местного 5 % 5-фторурацила для химиопрофилактики карциномы из кератиноцитов продемонстрировало, что стандартный курс лечения АК лица продолжительностью 2-4 недели снижает риск возникновения плоскоклеточного рака в течение 1 года на 75 %[123].
Хотя авторы этого исследования выступают за использование 5-фторурацила в профилактических целях, для понимания механизма прогрессирования рака кожи от актинического кератоза до карциномы из кератиноцитов необходимы более долгосрочные наблюдения.
Заключение
Анализ доказательств, полученных из этого систематического обзора, который основывался на 5 исследовательских вопросах, позволил вывести рекомендации и предложения по лечению актинического кератоза, подкрепленные фактическими данными.
Настоятельно было рекомендовано применение:
- УФ-защиты;
- криохирургии;
- имиквимода (местно);
- 5-фторурацила (местно).
Также были даны условные рекомендации об использовании ФДТ и диклофенака как отдельно, так и в качестве элементов комбинированной терапии.
Данные выводы базируются на лучших из доступных в настоящее время данных. Результаты будущих исследований могут потребовать пересмотра текущих рекомендаций. Обзор был ограничен англоязычной литературой, поэтому он может не учитывать данные релевантных исследований, опубликованных на других языках.
Заключение от Д.С.: Напомню, что устанавливать диагноз «актинический кератоз» и назначать лечение должен врач. Чаще всего, для установки диагноза АК бывает достаточно дерматоскопии, в сложных случаях может потребоваться шейв- или панч-биопсия.
Записаться на приём[1] Uhlenhake EE. Optimal treatment of actinic keratoses. Clin Interv Aging. 2013;8:29-35.
[2] Singal AG, Higgins PDR, Waljee AK. A primer on effectiveness and efficacy trials. Clin Transl Gastroenterol. 2014;5(1):e45.
[3] Rossi R, Mori M, Lotti T. Actinic keratosis. Int J Dermatol. 2007; 46(9):895-904.
[4] Moy RL. Clinical presentation of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000;42(1 Part 2):8-10.
[5] Rossi R, Mori M, Lotti T. Actinic keratosis. Int J Dermatol. 2007; 46(9):895-904.
[6] Olsen EA, Abernethy ML, Kulp-Shorten C, et al. A doubleblind, vehicle-controlled study evaluating masoprocol cream in the treatment of actinic keratoses on the head and neck. J Am Acad Dermatol. 1991;24(5 Pt 1):738-743.
[7] Rossi R, Mori M, Lotti T. Actinic keratosis. Int J Dermatol. 2007; 46(9):895-904.
[8] Schmitt JV, Miot HA. Actinic keratosis: a clinical and epidemiological revision. An Bras Dermatol. 2012;87(3):425- 434.
[9] Butani AK, Arbesfeld DM, Schwartz RA. Premalignant and early squamous cell carcinoma. Clin Plast Surg. 2005;32(2): 223-235
[10] Peris K, Micantonio T, Piccolo D, Fargnoli MC. Dermoscopic features of actinic keratosis. J Dtsch Dermatol Ges. 2007;5(11): 970-976.
[11] Moy RL. Clinical presentation of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000;42(1 Part 2):8-10.
[12] Cockerell CJ. Histopathology of incipient intraepidermal squamous cell carcinoma (‘‘actinic keratosis’’). J Am Acad Dermatol. 2000;42(1 Pt 2):11-17.
[13] R€owert-Huber J, Patel MJ, Forschner T, et al. Actinic keratosis is an early in situ squamous cell carcinoma: a proposal for reclassification. Br J Dermatol. 2007;156(Suppl 3):8-12.
[14] Wei J, Kok LF, Byrne SN, Halliday GM. Photodamage: all signs lead to actinic keratosis and early squamous cell carcinoma. Curr Probl Dermatol. 2015; 46:14-19.
[15] Ackerman AB, Mones JM. Solar (actinic) keratosis is squamous cell carcinoma. Br J Dermatol. 2006;155(1):9-22.
[16] Lober BA, Lober CW. Actinic keratosis is squamous cell carcinoma. South Med J. 2000;93(7):650-655.
[17] Heaphy MR Jr, Ackerman AB. The nature of solar keratosis: a critical review in historical perspective. J Am Acad Dermatol. 2000;43(1 Pt 1):138-150.
[18] Cockerell CJ. Histopathology of incipient intraepidermal squamous cell carcinoma (‘‘actinic keratosis’’). J Am Acad Dermatol. 2000;42(1 Pt 2):11-17.
[19] Goldberg LH, Joseph AK, Tschen JA. Proliferative actinic keratosis. Int J Dermatol. 1994;33(5):341-345.
[20] Zalaudek I, Piana S, Moscarella E, et al. Morphologic grading and treatment of facial actinic keratosis. Clin Dermatol. 2014; 32(1):80-87.
[21] Schmitz L, Gambichler T, Gupta G, et al. Actinic keratoses show variable histological basal growth patternsea proposed classification adjustment. J Eur Acad Dermatol Venereol. 2018;32(5):745-751.
[22] Schmitz L, Gupta G, St€ucker M, et al. Evaluation of two histological classifications for actinic keratosesePRO classification scored highest inter-rater reliability. J Eur Acad Dermatol Venereol. 2019;33(6):1092-1097.
[23] Schmitz L, Kahl P, Majores M, Bierhoff E, Stockfleth E, Dirschka T. Actinic keratosis: correlation between clinical and histological classification systems. J Eur Acad Dermatol Venereol. 2016;30(8):1303-1307.
[24] Salasche SJ. Epidemiology of actinic keratoses and squamous cell carcinoma. J Am Acad Dermatol. 2000;42(1 Pt 2):4-7.
[25] Goldberg LH, Mamelak AJ. Review ofactinic keratosis. Part I: etiology, epidemiology and clinical presentation. J Drugs Dermatol. 2010;9(9):1125-1132.
[26] Marks R, Foley P, Goodman G, Hage BH, Selwood TS. Spontaneous remission of solar keratoses: the case for conservative management. Br J Dermatol. 1986;115(6):649-655.
[27] Fuchs A, Marmur E. The kinetics of skin cancer: progression of actinic keratosis to squamous cell carcinoma. Dermatol Surg. 2007;33(9):1099-1101.
[28] Marks R, Rennie G, Selwood TS. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet. 1988; 1(8589):795-797.
[29] Berman B, Cockerell CJ. Pathobiology of actinic keratosis: ultraviolet-dependent keratinocyte proliferation. J Am Acad Dermatol. 2013;68(Suppl 1):S10-S19.
[30] Czarnecki D, Meehan CJ, Bruce F, Culjak G. The majority of cutaneous squamous cell carcinomas arise in actinic keratoses. J Cutan Med Surg. 2002;6(3):207-209.
[31] Elmets CA, Viner JL, Pentland AP, et al. Chemoprevention of nonmelanoma skin cancer with celecoxib: a randomized, double-blind, placebo-controlled trial. J Natl Cancer Inst. 2010;102(24):1835-1844.
[32] Glogau RG. The risk of progression to invasive disease. J Am Acad Dermatol. 2000;42(1 Pt 2):23-24.
[33] Mittelbronn MA, Mullins DL, Ramos-Caro FA, Flowers FP. Frequency of pre-existing actinic keratosis in cutaneous squamous cell carcinoma. Int J Dermatol. 1998;37(9):677-681.
[34] Stockfleth E. The paradigm shift in treating actinic keratosis: a comprehensive strategy. J Drugs Dermatol. 2012;11(12):1462- 1467.
[35] Berman B, Cockerell CJ. Pathobiology of actinic keratosis: ultraviolet-dependent keratinocyte proliferation. J Am Acad Dermatol. 2013;68(Suppl 1):S10-S19.
[36] Timares L, Katiyar SK, Elmets CA. DNA damage, apoptosis and langerhans cellseActivators of UV-induced immune tolerance. Photochem Photobiol. 2008;84(2):422-436.
[37] Brash DE, Ziegler A, Jonason AS, Simon JA, Kunala S, Leffell DJ. Sunlight and sunburn in human skin cancer: p53, apoptosis, and tumor promotion. J Investig Dermatol Symp Proc. 1996;1(2):136-142.
[38] Ziegler A, Jonason AS, Leffell DJ, et al. Sunburn and p53 in the onset of skin cancer. Nature. 1994;372(6508):773-776.
[39] Ratushny V, Gober MD, Hick R, Ridky TW, Seykora JT. From keratinocyte to cancer: the pathogenesis and modeling of cutaneous squamous cell carcinoma. J Clin Invest. 2012; 122(2):464-472.
[40] Roewert-Huber J, Stockfleth E, Kerl H. Pathology and pathobiology of actinic (solar) keratosisean update. Br J Dermatol. 2007;157(Suppl 2):18-20.
[41] Kanellou P, Zaravinos A, Zioga M, et al. Genomic instability, mutations and expression analysis of the tumour suppressor genes p14(ARF), p15(INK4b), p16(INK4a) and p53 in actinic keratosis. Cancer Lett. 2008;264(1):145-161.
[42] Padilla RS, Sebastian S, Jiang Z, Nindl I, Larson R. Gene expression patterns of normal human skin, actinic keratosis, and squamous cell carcinoma: a spectrum of disease progression. Arch Dermatol. 2010;146(3):288-293.
[43] Hodges A, Smoller BR. Immunohistochemical comparison of p16 expression in actinic keratoses and squamous cell carcinomas of the skin. Mod Pathol. 2002;15(11):1121-1125.
[44] Mortier L, Marchetti P, Delaporte E, et al. Progression of actinic keratosis to squamous cell carcinoma of the skin correlates with deletion of the 9p21 region encoding the p16(INK4a) tumor suppressor. Cancer Lett. 2002;176(2):205-214.
[45] Simon MM, Aragane Y, Schwarz A, Luger TA, Schwarz T. UVB light induces nuclear factor kappa B (NF kappa B) activity independently from chromosomal DNA damage in cell-free cytosolic extracts. J Invest Dermatol. 1994;102(4):422-427.
[46] Marks R, Rennie G, Selwood TS. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet. 1988; 1(8589):795-797.
[47] Elmets CA, Viner JL, Pentland AP, et al. Chemoprevention of nonmelanoma skin cancer with celecoxib: a randomized, double-blind, placebo-controlled trial. J Natl Cancer Inst. 2010;102(24):1835-1844.
[48] Criscione VD, Weinstock MA, Naylor MF, Luque C, Eide MJ, Bingham SF. Actinic keratoses: natural history and risk of malignant transformation in the Veterans Affairs Topical Tretinoin Chemoprevention Trial. Cancer. 2009;115(11):2523-2530.
[49] Werner RN, Sammain A, Erdmann R, Hartmann V, Stockfleth E, Nast A. The natural history of actinic keratosis: a systematic review. Br J Dermatol. 2013;169(3):502-518.
[50] Czarnecki D, Meehan CJ, Bruce F, Culjak G. The majority of cutaneous squamous cell carcinomas arise in actinic keratoses. J Cutan Med Surg. 2002;6(3):207-209.
[51] Mittelbronn MA, Mullins DL, Ramos-Caro FA, Flowers FP. Frequency of pre-existing actinic keratosis in cutaneous squamous cell carcinoma. Int J Dermatol. 1998;37(9):677-681.
[52] Criscione VD, Weinstock MA, Naylor MF, Luque C, Eide MJ, Bingham SF. Actinic keratoses: natural history and risk of malignant transformation in the Veterans Affairs Topical Tretinoin Chemoprevention Trial. Cancer. 2009;115(11):2523-2530.
[53] Werner RN, Sammain A, Erdmann R, Hartmann V, Stockfleth E, Nast A. The natural history of actinic keratosis: a systematic review. Br J Dermatol. 2013;169(3):502-518.
[54] Werner RN, Sammain A, Erdmann R, Hartmann V, Stockfleth E, Nast A. The natural history of actinic keratosis: a systematic review. Br J Dermatol. 2013;169(3):502-518.
[55] Esmann S. Patients’ perspectives on actinic keratosis. Curr Probl Dermatol. 2015;46:8-13.
[56] Marks R, Rennie G, Selwood TS. Malignant transformation of solar keratoses to squamous cell carcinoma. Lancet. 1988; 1(8589):795-797.
[57] Criscione VD, Weinstock MA, Naylor MF, Luque C, Eide MJ, Bingham SF. Actinic keratoses: natural history and risk of malignant transformation in the Veterans Affairs Topical Tretinoin Chemoprevention Trial. Cancer. 2009;115(11):2523-2530.
[58] Harvey I, Frankel S, Marks R, Shalom D, Nolan-Farrell M. Nonmelanoma skin cancer and solar keratoses. I. Methods and descriptive results of the South Wales Skin Cancer Study. Br J Cancer. 1996;74(8):1302-1307.
[59] Stockfleth E. The importance of treating the field in actinic keratosis. J Eur Acad Dermatol Venereol. 2017;31(Suppl 2):8-11.
[60] Thompson SC, JolleyD,Marks R. Reduction of solar keratoses by regular sunscreen use. N Engl J Med. 1993;329(16):1147-1151.
[61] Darlington S, Williams G, Neale R, Frost C, Green A. A randomized controlled trial to assess sunscreen application and beta carotene supplementation in the prevention of solar keratoses. Arch Dermatol. 2003;139(4):451-455.
[62] Thompson SC, JolleyD,Marks R. Reduction of solar keratoses by regular sunscreen use. N Engl J Med. 1993;329(16):1147-1151.
[63] Darlington S, Williams G, Neale R, Frost C, Green A. A randomized controlled trial to assess sunscreen application and beta carotene supplementation in the prevention of solar keratoses. Arch Dermatol. 2003;139(4):451-455.
[64] Akarsu S, Aktan S, Atahan A, Koc P, Ozkan S. Comparison of topical 3 % diclofenac sodium gel and 5 % imiquimod cream for the treatment of actinic keratoses. Clin Exp Dermatol. 2011;36(5):479-484.
[65] Kose O, Koc E, Erbil AH, Caliskan E, Kurumlu Z. Comparison of the efficacy and tolerability of 3 % diclofenac sodium gel and 5 % imiquimod cream in the treatment of actinic keratosis. J Dermatolog Treat. 2008;19(3):159-163.
[66] Krawtchenko N, Roewert-Huber J, Ulrich M, Mann I, Sterry W, Stockfleth E. A randomised study of topical 5 % imiquimod vs. topical 5-fluorouracil vs. cryosurgery in immunocompetent patients with actinic keratoses: a comparison of clinical and histological outcomes including 1-year follow-up. Br J Dermatol. 2007;157(suppl 2):34-40.
[67] Tanghetti E, Werschler P. Comparison of 5 % 5-fluorouracil cream and 5 % imiquimod cream in the management of actinic keratoses on the face and scalp. J Drugs Dermatol. 2007;6(2):144-147.
[68] Segatto MM, Dornelles SI, Silveira VB, Frantz Gde O. Comparative study of actinic keratosis treatment with 3 % diclofenac sodium and 5 % 5-fluorouracil. An Bras Dermatol. 2013;88(5): 732-738.
[69] Smith SR, Morhenn VB, Piacquadio DJ. Bilateral comparison of the efficacy and tolerability of 3 % diclofenac sodium gel and 5 % 5-fluorouracil cream in the treatment of actinic keratoses of the face and scalp. J Drugs Dermatol. 2006;5(2): 156-159.
[70] Lubritz RR, Smolewski SA. Cryosurgery cure rate of actinic keratoses. J Am Acad Dermatol. 1982;7(5):631-632.
[71] Foley P, Merlin K, Cumming S, et al. A comparison of cryotherapy and imiquimod for treatment of actinic keratoses: lesion clearance, safety, and skin quality outcomes. J Drugs Dermatol. 2011;10(12):1432-1438.
[72] Freeman M, Vinciullo C, Francis D, et al. A comparison of photodynamic therapy using topical methyl aminolevulinate (Metvix) with single cycle cryotherapy in patients with actinic keratosis: a prospective, randomized study. J Dermatolog Treat. 2003;14(2):99-106.
[73] Szeimies RM, Karrer S, Radakovic-Fijan S, et al. Photodynamic therapy using topical methyl 5-aminolevulinate compared with cryotherapy for actinic keratosis: a prospective, randomized study. J Am Acad Dermatol. 2002; 47(2):258-262.
[74] Ianhez M, Miot HA, Bagatin E. Liquid nitrogen for the treatment of actinic keratosis: a longitudinal assessment. Cryobiology. 2014;69(1):140-143.
[75] Thai KE, Fergin P, Freeman M, et al. A prospective study of the use of cryosurgery for the treatment of actinic keratoses. Int J Dermatol. 2004;43(9):687-692.
[76] Zane C, Facchinetti E, Rossi MT, Specchia C, Ortel B, Calzavara-Pinton P. Cryotherapy is preferable to ablative CO2 laser for the treatment of isolated actinic keratoses of the face and scalp: a randomized clinical trial. Br J Dermatol. 2014;170(5):1114-1121.
[77] Piacquadio DJ, Chen DM, Farber HF, et al. Photodynamic therapy with aminolevulinic acid topical solution and visible blue light in the treatment of multiple actinic keratoses of the face and scalp: investigator-blinded, phase 3, multicenter trials. Arch Dermatol. 2004;140(1):41-46.
[78] Tschen EH, Wong DS, Pariser DM, et al. Photodynamic therapy using aminolaevulinic acid for patients with nonhyperkeratotic actinic keratoses of the face and scalp: phase IV multicentre clinical trial with 12-month follow up. Br J Dermatol. 2006;155(6):1262-1269.
[79] Petukhova TA, Hassoun LA, Foolad N, Barath M, Sivamani RK. Effect of expedited microneedle-assisted photodynamic therapy for field treatment of actinic keratoses: a randomized clinical rrial. JAMA Dermatol. 2017;153(7):637-643.
[80] Gandy J, Labadie B, BiermanD, Zachary C. Photodynamic therapy effectively treats actinic keratoses without pre-illumination incubation time. J Drugs Dermatol. 2017;16(3):275-278.
[81] Wiegell SR, Haedersdal M, Philipsen PA, Eriksen P, Enk CD, Wulf HC. Continuous activation of PpIX by daylight is as effective as and less painful than conventional photodynamic therapy for actinic keratoses: a randomized, controlled, singleblinded study. Br J Dermatol. 2008;158(4):740-746.
[82] Lev-Tov H, Larsen L, Zackria R, Chahal H, Eisen DB, Sivamani RK. Microneedle-assisted incubation during aminolaevulinic acid photodynamic therapy of actinic keratoses: a randomized controlled evaluator-blind trial. Br J Dermatol. 2017;176(2):543-545.
[83] Freeman M, Vinciullo C, Francis D, et al. A comparison of photodynamic therapy using topical methyl aminolevulinate (Metvix) with single cycle cryotherapy in patients with actinic keratosis: a prospective, randomized study. J Dermatolog Treat. 2003;14(2):99-106.
[84] Wiegell SR, Haedersdal M, Philipsen PA, Eriksen P, Enk CD, Wulf HC. Continuous activation of PpIX by daylight is as effective as and less painful than conventional photodynamic therapy for actinic keratoses: a randomized, controlled, singleblinded study. Br J Dermatol. 2008;158(4):740-746.
[85] Braathen LR, Paredes BE, Saksela O, et al. Short incubation with methyl aminolevulinate for photodynamic therapy of actinic keratoses. J Eur Acad Dermatol Venereol. 2009;23(5): 550-555.
[86] Lacour JP, Ulrich C, Gilaberte Y, et al. Daylight photodynamic therapy with methyl aminolevulinate cream is effective and nearly painless in treating actinic keratoses: a randomised, investigator-blinded, controlled, phase III study throughout Europe. J Eur Acad Dermatol Venereol. 2015;29(12):2342-2348.
[87] Neittaanmaki-Perttu N, Gronroos M, Karppinen T, Snellman E, Rissanen P. Photodynamic therapy for actinic keratoses: a randomized prospectivenon-sponsored cost-effectiveness study of daylight-mediated treatment compared with light-emitting diode treatment. Acta Derm Venereol. 2016;96(2):241-244.
[88] Pariser D, Loss R, Jarratt M, et al. Topical methylaminolevulinate photodynamic therapy using red lightemitting diode light for treatment of multiple actinic keratoses: a randomized, double-blind, placebo-controlled study. J Am Acad Dermatol. 2008;59(4):569-576.
[89] Pariser DM, Lowe NJ, Stewart DM, et al. Photodynamic therapy with topical methyl aminolevulinate for actinic keratosis: results of a prospective randomized multicenter trial. J Am Acad Dermatol. 2003;48(2):227-232.
[90] Rubel DM, Spelman L, Murrell DF, et al. Daylight photodynamic therapy with methyl aminolevulinate cream as a convenient, similarly effective, nearly painless alternative to conventional photodynamic therapy in actinic keratosis treatment: a randomized controlled trial. Br J Dermatol. 2014;171(5):1164-1171.
[91] Sotiriou E, Evangelou G, Papadavid E, et al. Conventional vs. daylight photodynamic therapy for patients with actinic keratosis on face and scalp: 12-month follow-up results of a randomized, intra-individual comparative analysis. J Eur Acad Dermatol Venereol. 2018;32(4):595-600.
[92] Szeimies RM, Matheson RT, Davis SA, et al. Topical methyl aminolevulinate photodynamic therapy using red lightemitting diode light for multiple actinic keratoses: a randomized study. Dermatol Surg. 2009;35(4):586-592.
[93] Tarstedt M, Rosdahl I, Berne B, Svanberg K, Wennberg AM. A randomized multicenter study to compare two treatment regimens of topical methyl aminolevulinate (Metvix)-PDT in actinic keratosis of the face and scalp. Acta Derm Venereol. 2005;85(5):424-428.
[94] Wiegell SR, Haedersdal M, Eriksen P, Wulf HC. Photodynamic therapy of actinic keratoses with 8 % and 16 % methyl aminolaevulinate and home-based daylight exposure: a double-blinded randomized clinical trial. Br J Dermatol. 2009;160(6):1308-1314.
[95] Dirschka T, Radny P, Dominicus R, et al. Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a multicentre, randomized, observerblind phase III study in comparison with a registered methyl- 5-aminolaevulinate cream and placebo. Br J Dermatol. 2012; 166(1):137-146.
[96] Dirschka T, Radny P, Dominicus R, et al. Long-term (6 and 12 months) follow-up of two prospective, randomized, controlled phase III trials of photodynamic therapy with BF-200 ALA and methyl aminolaevulinate for the treatment of actinic keratosis. Br J Dermatol. 2013;168(4):825-836.
[97] Reinhold U, Dirschka T, Ostendorf R, et al. A randomized, double-blind, phase III, multicentre study to evaluate the safety and efficacy of BF-200 ALA (Ameluz) vs. placebo in the field-directed treatment of mild-to-moderate actinic keratosis with photodynamic therapy (PDT) when using the BFRhodoLED) lamp. Br J Dermatol. 2016;175(4):696-705.
[98] Szeimies RM, Radny P, Sebastian M, et al. Photodynamic therapy with BF-200 ALA for the treatment of actinic keratosis: results of a prospective, randomized, doubleblind, placebo-controlled phase III study. Br J Dermatol. 2010;163(2):386-394.
[99] Dirschka T, Radny P, Dominicus R, et al. Long-term (6 and 12 months) follow-up of two prospective, randomized, controlled phase III trials of photodynamic therapy with BF-200 ALA and methyl aminolaevulinate for the treatment of actinic keratosis. Br J Dermatol. 2013;168(4):825-836.
[100] Vegter S, Tolley K. A network meta-analysis of the relative efficacy of treatments for actinic keratosis of the face or scalp in Europe. PLoS One. 2014;9(6):e96829.
[101] Zhu L, Wang P, Zhang G, et al. Conventional versus daylight photodynamic therapy for actinic keratosis: a randomized and prospective study in China. Photodiagnosis Photodyn Ther. 2018;24:366-371.
[102] Jeffes EW, McCullough JL, Weinstein GD, Kaplan R, Glazer SD, Taylor JR. Photodynamic therapy of actinic keratoses with topical aminolevulinic acid hydrochloride and fluorescent blue light. J Am Acad Dermatol. 2001;45(1):96-104.
[103] Pariser DM, Houlihan A, Ferdon MB, Berg JE, Group P-AI. Randomized vehicle-controlled study of short drug incubation aminolevulinic acid photodynamic therapy for actinic keratoses of the face or scalp. Dermatol Surg. 2016;42(3):296-304.
[104] Schmieder GJ, Huang EY, Jarratt M. A multicenter, randomized, vehicle-controlled phase 2 study of blue light photodynamic therapy with aminolevulinic acid HCl 20 % topical solution for the treatment of actinic keratoses on the upper extremities: the effect of occlusion during the drug incubation period. J Drugs Dermatol. 2012;11(12):1483-1489.
[105] Piacquadio DJ, Chen DM, Farber HF, et al. Photodynamic therapy with aminolevulinic acid topical solution and visible blue light in the treatment of multiple actinic keratoses of the face and scalp: investigator-blinded, phase 3, multicenter trials. Arch Dermatol. 2004;140(1):41-46.
[106] Jeffes EW, McCullough JL, Weinstein GD, Kaplan R, Glazer SD, Taylor JR. Photodynamic therapy of actinic keratoses with topical aminolevulinic acid hydrochloride and fluorescent blue light. J Am Acad Dermatol. 2001;45(1):96-104.
[107] Pariser DM, Houlihan A, Ferdon MB, Berg JE, Group P-AI. Randomized vehicle-controlled study of short drug incubation aminolevulinic acid photodynamic therapy for actinic keratoses of the face or scalp. Dermatol Surg. 2016;42(3):296-304.
[108] Schmieder GJ, Huang EY, Jarratt M. A multicenter, randomized, vehicle-controlled phase 2 study of blue light photodynamic therapy with aminolevulinic acid HCl 20 % topical solution for the treatment of actinic keratoses on the upper extremities: the effect of occlusion during the drug incubation period. J Drugs Dermatol. 2012;11(12):1483-1489.
[109] Pariser DM, Houlihan A, Ferdon MB, Berg JE, Group P-AI. Randomized vehicle-controlled study of short drug incubation aminolevulinic acid photodynamic therapy for actinic keratoses of the face or scalp. Dermatol Surg. 2016;42(3):296-304.
[110] Brian Jiang SI, Kempers S, Rich P, et al. A randomized, vehiclecontrolled phase 3 study of aminolevulinic acid photodynamic therapy for the treatment of actinic keratoses on the upper extremities. Dermatol Surg. 2019;45(7):890-897.
[111] Willey A, Anderson RR, Sakamoto FH. Temperature-modulated photodynamic therapy for the treatment of actinic keratosis on the extremities: a pilot study. Dermatol Surg. 2014;40(10):1094-1102.
[112] Willey A. Thermal photodynamic therapy for actinic keratoses on facial skin: a proof-of-concept study. Dermatol Surg. 2019; 45(3):404-410.
[113] Jorizzo J, Weiss J, Vamvakias G. One-week treatment with 0.5 % fluorouracil cream prior to cryosurgery in patients with actinic keratoses: a double-blind, vehicle-controlled, longterm study. J Drugs Dermatol. 2006;5(2):133-139.
[114] Hoover WD III, Jorizzo JL, Clark AR, Feldman SR, Holbrook J, Huang KE. Efficacy of cryosurgery and 5-fluorouracil cream 0.5 % combination therapy for the treatment of actinic keratosis. Cutis. 2014;94(5):255-259.
[115] Jorizzo J, Weiss J, Vamvakias G. One-week treatment with 0.5 % fluorouracil cream prior to cryosurgery in patients with actinic keratoses: a double-blind, vehicle-controlled, longterm study. J Drugs Dermatol. 2006;5(2):133-139
[116] Jorizzo JL, Markowitz O, Lebwohl MG, et al. A randomized, double-blinded, placebo-controlled, multicenter, efficacy and safety study of 3.75 % imiquimod cream following cryosurgery for the treatment of actinic keratoses. J Drugs Dermatol. 2010;9(9):1101-1108.
[117] Goldenberg G, Linkner RV, Singer G, Frankel A. An investigator-initiated study to assess the safety and efficacy of imiquimod 3.75 % cream when used after cryotherapy in the treatment of hypertrophic actinic keratoses on dorsal hands and rorearms. J Clin Aesthet Dermatol. 2013;6(2):36-43.
[118] Tan JK, Thomas DR, Poulin Y, Maddin F, Tang J. Efficacy of imiquimod as an adjunct to cryotherapy for actinic keratoses. J Cutan Med Surg. 2007;11(6):195-201.
[119] Shaffelburg M. Treatment of actinic keratoses with sequential use of photodynamic therapy; and imiquimod 5 % cream. J Drugs Dermatol. 2009;8(1):35-39.
[120] Herman S, Rogers HD, Ratner D. Immunosuppression and squamous cell carcinoma: a focus on solid organ transplant recipients. Skinmed. 2007;6(5):234-238.
[121] Tam S, Gross ND. Cutaneous squamous cell carcinoma in immunosuppressed patients. Curr Oncol Rep. 2019;21(9): 82.
[122] Gollnick H, Dirschka T, Ostendorf R, Kerl H, Kunstfeld R. Longterm clinical outcomes of imiquimod 5 % cream vs. diclofenac 3 % gel for actinic keratosis on the face or scalp: a pooled analysis of two randomized controlled trials. J Eur Acad Dermatol Venereol. 2020;34(1):82-89.
[123] Weinstock MA, Thwin SS, Siegel JA, et al. Chemoprevention of basal and squamous cell carcinoma with a single course of fluorouracil, 5 %, cream: a randomized clinical trial. JAMA Dermatol. 2018;154(2):167-174.
Другие статьи:
- Избирательная цифровая дерматоскопия (ИЦД)
- Меланома кожи 2020: столкновение с реальностью
- Как проводят гистологическое исследование образований кожи
- Вред солярия - меланома и рак кожи
Полезная статья? Сделайте репост в Вашей социальной сети!

