Как чаще развивается меланома: из невусов или де-ново – ДЛЯ КОЛЛЕГ
Предисловие от Д.С.:
Очень рекомендую прочитать эту статью тем коллегам, которые не знакомы с ней. Вдумчиво, без суеты, возможно даже несколько раз. В этом достаточно крупном метаанализе содержится разрушение многих бытующих у нас стереотипов.
Pampena R, Kyrgidis A, Lallas A, Moscarella E, Argenziano G, Longo C.
A meta-analysis of nevus-associated melanoma: Prevalence and practical implications.
J Am Acad Dermatol. 2017 Nov;77(5):938-945.e4. doi: 10.1016/j.jaad.2017.06.149. Epub 2017 Aug 29. Review.
Существуют разные данные о распространенности невус-ассоциированной меланомы. Группа врачей под руководством Рикардо Пампена выполнила метаанализ и обзор научной литературы, чтобы определить актуальную распространенность и частоту меланом этого типа. Также исследователи классифицировали данные по возрасту пациентов, толщине опухоли по Бреслоу и типам невусов, из которых развилось злокачественное новообразование.
По сводным данным 38 исследований, в 29,1 % случаев меланома развивается из существующих невусов, а в 70,9 % случаев опухоль появляется на фоне чистой кожи или де-ново. Вероятность обнаружить невус-ассоциированную меланому на 64 % ниже, чем увидеть во время осмотра меланому де-ново. Невус-ассоциированные меланомы имеют меньшую толщину по Бреслоу, чем меланомы де-ново. Существенной разницы между частотой развития невус-ассоциированной меланомы из диспластических и обычных невусов не зафиксировано.
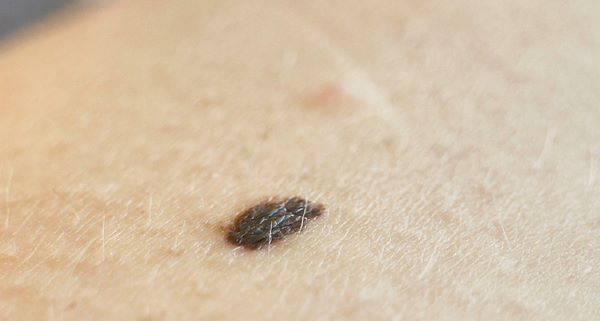
Поверхностно распространяющаяся меланома, стадия Ia
Справка: невус-ассоциированные меланомы развиваются на фоне существующих невусов или, как говорят обыватели, «из родинок». Меланомы де-ново появляются на чистой коже.
Невус-ассоциированная меланома определяется по результатам гистопатологического анализа, во время которого врач-лаборант видит клетки невуса и меланомы. По данным исследований, невус-ассоциированная меланома чаще относится к поверхностно-распространяющемуся типу. Она обычно развивается на коже туловища молодых пациентов [1–4].
Меланома де-ново встречается чаще невус-ассоциированной меланомы. Во время гистопатологического исследования врач не находит клеток невуса. Тем не менее частота и биологические особенности невус-ассоциированной меланомы четко не определены.
По данным исследований, опубликованных с конца 40-х годов XX века до настоящего времени, частота невус-ассоциированной меланомы варьируется от 4 % [5] до 72 % [6] от общего количества меланом. В метаанализе Лин и коллег, в ходе которого проанализированы результаты 25 научных работ, установлено, что в 36 % случаев меланом опухоль была невус-ассоциированной [2]. Некоторые вопросы, связанные с распространенностью невус-ассоциированной меланомы, не поддаются точному анализу из-за разнородности доступных данных. В частности, это касается вопросов толщины опухоли и типов невусов, из которых она развивается.
В некоторых исследованиях указывается, что чем толще опухоль, тем ниже вероятность обнаружить ткани нормального невуса во время гистопатологического исследования. Это связано со способностью злокачественной меланомы разрушать нормальные ткани [7]. Поэтому практически невозможно наверняка определить, как развилось новообразование: из существующего невуса или де-ново. Более того, данные о характеристиках невус-ассоциированных меланом недоступны или сильно разрознены. Например, по данным доступных научных работ невозможно точно характеризовать невусы, из которых развиваются меланомы, по таким характеристикам: врожденный или приобретенный, наличие или отсутствие дисплазии [4].
Несмотря на разрозненность данных, общепризнано, что часть меланом развивается из существующего невуса. Однако биологическое и прогностическое значение ассоциации меланомы с невусом остается предметом споров [2, 8–13]. Чтобы достоверно определить частоту невус-ассоциированных меланом, Рикардо Пампена с коллегами выполнили метаанализ доступных исследований по теме. Также исследователи систематизировали доступную информацию в разрезе возраста пациентов, толщины опухоли и классификации невусов на диспластические и нормальные.
Выбор тематических исследований
Пампена и коллеги установили критерии отбора исследований для метаанализа до начала изучения литературы. Ученые условились включить в подборку клинические испытания, когортные исследования, исследования типа «случай-контроль», в которых сообщается о соотношении невус-ассоциированных меланом к меланомам де-ново. Качество отобранных исследований оценивалось по шкале Ньюкасл-Оттава [14].
Отдельные кейсы в подборку не включали. Рецензии, абстракты, статьи для тематических изданий и кросс-секционные исследования, оказавшиеся в подборке, содержат данные, неопубликованные в других исследованиях. Исследования для анализа отбирали из баз Medline, Embase, Кокрейновской библиотеки.
Результаты анализа
Рикардо Пампена и его коллеги проанализировали научные работы, в которых учитываются 20 126 случаев меланомы.
Распространенность невус-ассоциированной меланомы
Доля невус-ассоциированных меланом составила 29,1 %. Согласно статистическим данным вероятность того, что выявленная меланома окажется невус-ассоциированной, на 64 % ниже, чем вероятность выявления меланомы де-ново.
Демографические данные и характеристики меланом
По данным девяти исследований [3, 11, 13–47], получена важная информация о возрасте пациентов. Пациенты с невус-ассоциированной меланомой в целом на 4,9 лет моложе пациентов с меланомой де-ново.
По данным 17 исследований [2, 8, 11, 13–47], существенной разницы между частотой возникновения невус-ассоциированной меланомы у мужчин и женщин нет. Также в проанализированных исследованиях не указана существенная разница между гистологическими типами меланомы и частями тела, на которых развивалась опухоль.
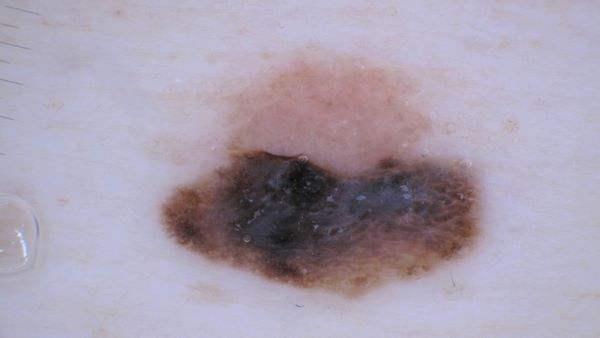
Невус-ассоциированная меланома
По данным гистологических заключений, чаще всего фиксировалась поверхностно-распространяющаяся меланома. Опухоли чаще всего развивались на коже туловища и конечностей. Это касается как невус-ассоциированной, так и меланомы де-ново.
Толщина невус-ассоциированной меланомы
Только в 16 проанализированных исследованиях указаны данные о толщине меланом де-ново по Бреслоу [2, 4, 13, 19–47]. Еще одно исследование [44] содержит информацию о толщине по Бреслоу невус-ассоциированных меланом.
На момент диагностики преобладают инвазивные меланомы как среди невус-ассоциированных, так и среди де-ново. Но в группе невус-ассоциированных меланом чаще диагностируются неинвазивные меланомы in situ. Из 2 057 невус-ассоциированных опухолей 408 или 19,8 % были in situ. В группе меланом де-ново из 4 995 опухолей только 727, или 14,6 %, не вошли в фазу инвазивного роста.
Среди невус-ассоциированных меланом относительно часто диагностируются меланомы in situ. При своевременном хирургическом удалении такой опухоли вероятность полного излечения составляет 100 %. Поэтому важно регулярно посещать дерматоонколога и выполнять дерматоскопию.
В восьми исследованиях указаны детальные данные о толщине меланом по Бреслоу [2, 3, 8, 11–47]. По сводным данным, невус-ассоциированные меланомы имеют меньшую толщину по Бреслоу по сравнению с меланомами де-ново. Средняя разница составляет 0,39 мм.
Классификация по типам невусов
Разделение невусов на врожденные и приобретенные указано в 13 исследованиях [3, 8, 10, 13–47]. В одном из исследований врожденные невусы исключены из выборки. С учетом неполноты данных исследователи заключили, что невус-ассоциированные меланомы чаще развиваются из приобретенных невусов. 1 612 меланом, или 77,4 %, развилось из приобретенных невусов, а 471, или 22,6 %, – из врожденных.
При исключении врожденных невусов невус-ассоциированные меланомы чаще развивались из интрадермальных невусов (618 опухолей, или 54 %) и сложных невусов (176 опухолей, 15,4 %).
Распространенность диспластических невусов
Данные о принадлежности невусов к атипичным и типичным указаны в 15 исследованиях [3, 4, 10, 13–47]. Меланома чаще развивается из обычных невусов. Однако разница незначительная. Из обычных невусов меланома развилась в 1 455 случаев (56,7 %), а из диспластических – в 1 112 случаев (43,3 %).
Общая выживаемость
По данным 28 исследований, средняя выживаемость пациентов составляет 9,3 года [2–4, 8, 10–47]. Однако только в двух исследованиях [8, 11] есть данные о выживаемости в разрезе невус-ассоциированных и де-ново меланом. Роде и коллеги зафиксировали смерть 10 из 64 пациентов с невус-ассоциированными меланомами. В группе пациентов с меланомами де-ново умер 41 пациент из 168 [8].
Фридман и коллеги зафиксировали смерть 10 пациентов из 130 с невус-ассоциированными меланомами. Умерло 78 пациентов из 427 с меланомами де-ново [11]. По данным двух исследований, более благоприятный прогноз выживаемости имеют невус-ассоциированные меланомы.
Пять исследований [2, 3, 11–22] изучают смертность с помощью мультивариативного анализа и процедуры Каплана-Мейера. По данным Лин и коллег [2], Кадду и коллег [3] и Кокран и коллег [22], разница выживаемости пациентов с невус-ассоциированными и де-ново меланомами несущественная.
По информации Фридмана и коллег [11], пятилетняя выживаемость для пациентов с невус-ассоциированными меланомами составляет 91 %. Для пациентов с меланомами де-ново этот показатель составляет 78 %. Циммерман и коллеги также зафиксировали худший прогноз для меланом де-ново [21].
Выводы по результатам метаанализа
Главный вывод по результатам метаанализа научных исследований: меланомы реже развиваются из невусов, чем де-ново. Доля невус-ассоциированных меланом составляет 29,1 %, а доля меланом де-ново достигает 70,9 %. То есть метаанализ доказывает, что большая часть меланом развивается на чистой коже, а не возникает из перерожденных клеток невуса.
Исследование Рикардо Пампены не позволило ответить на вопрос, возникают ли невус-ассоциированные меланомы в результате малигнизации или злокачественного перерождения клеток невуса. Но данные проанализированных исследований не позволяют сказать, что невус-ассоциированные меланомы не связаны с невусами и развиваются в них случайно. Частота невус-ассоциированных меланом коррелирует с количеством невусов у отдельного пациента или в популяции: чем больше невусов обследует врач, тем больше невус-ассоциированных меланом выявляет [48].
Более того, есть данные [49] об одинаковом мутационном статусе клеток невусов и связанных с ними меланом. Это косвенно подтверждает общее происхождение невуса и ассоциированной с ним меланомы или злокачественное перерождение меланоцитов невуса с дальнейшим развитием опухоли. Однако этих данных недостаточно, чтобы однозначно назвать невусы образованиями-предшественниками невус-ассоциированных меланом. Это особенно актуально в связи с крайне низкими шансами любого отдельно взятого невуса превратиться в меланому [50].
Второй важный вывод по результатам метаанализа – разница в толщине по Бреслоу между невус-ассоциированными и де-ново меланомами. Средняя толщина невус-ассоциированных опухолей оказалась ниже аналогичного показателя меланом де-ново. Этот результат нужно воспринимать с оговоркой: в запущенных случаях опухоли могут уничтожать остатки невусов. Поэтому меланомы с большой толщиной по Бреслоу могли в части случаев квалифицироваться как де-ново, а не как невус-ассоциированные [7].
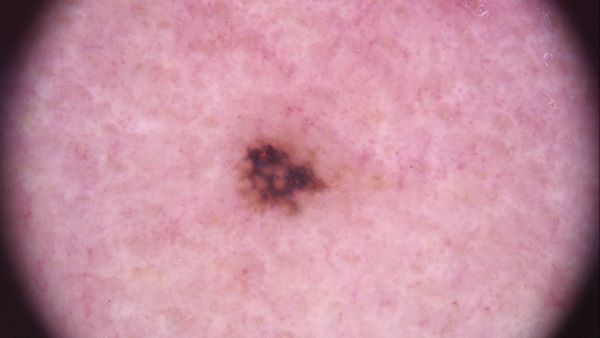
Меланома in situ
Данные о меньшей толщине невус-ассоциированных меланом косвенно подтверждаются более высокой выживаемостью пациентов с этой формой опухоли. Несколько исследований подтверждают, что пациенты с невус-ассоциированными меланомами живут дольше людей с меланомами де-ново [2, 3, 8–22]. Но разница по данным всех указанных работ статистически незначительная. Только в исследовании Циммермана и коллег [21] методом мультивариантного анализа достоверно подтверждается более высокая выживаемость пациентов с невус-ассоциированными меланомами.
Рикардо Пампена с коллегами изучили невус-ассоциированные меланомы в разрезе типов невусов, на фоне которых развивалась опухоль. Однако достоверность метаанализа оказалась ограниченной из-за неоднородности данных о типах невусов в отобранных исследованиях. В нескольких исследованиях есть данные о типах невусов, на фоне которых развилась меланома: врожденные и приобретенные. В одном исследовании рассматриваются только меланомы, появившиеся на фоне приобретенных невусов.
По сводным данным, 77,4 % невус-ассоциированных меланом развиваются на фоне приобретенных невусов. Большая часть приобретенных невусов, на фоне которых развивается опухоль, относится к интрадермальному типу. Такие невусы обычно появляются в раннем детстве [51].
Исходя из этого, дерматологи и онкологи должны помнить: меланома может развиваться на фоне давно существующего интрадермального невуса. Поэтому во время осмотра пациента нужно выполнять дерматоскопию всех образований независимо от срока их существования.
Таблица 1: Типы невусов, на фоне которых развиваются меланомы
| Тип невуса | Количество исследований | Количество меланом (и доля в %) |
| Врожденный и приобретенный | ||
| Врожденный | 13 | 471 (22,6 %) |
| Приобретенный | 13 | 1 612 (77,4 %) |
| Всего | 2 083 (100 %) | |
| Диспластический и типичный | ||
| Диспластический | 15 | 1 112 (43,3 %) |
| Типичный | 15 | 1 455 (56,7 %) |
| Всего | 2 567 (100 %) | |
| Пограничный, сложный и дермальный | ||
| Пограничный | ||
| Диспластический | 12 | 135 (54,2 %) |
| Типичный | 13 | 114 (45,8 %) |
| Всего | 13 | 249 (21,7 %) |
| Сложный | ||
| Диспластический | 12 | 118 (67 %) |
| Типичный | 14 | 58 (33 %) |
| Всего | 14 | 176 (15,4 %) |
| Дермальный | 15 | 618 (54 %) |
| Нет классификации по типам невусов | 18 | 102 (8,9 %) |
| Всего | 1 145 |
В ходе метаанализа установлено, что пациенты с невус-ассоциированными меланомами значительно моложе пациентов с опухолями де-ново.
Это можно было бы объяснить уменьшением количества невусов с возрастом. Установлено, что количество невусов в одинаковых по численности группах пациентов 60–69, 70–79 и 80–89 лет снижается. У пациентов из первой группы найдено 96 невусов (47,3 % от общего числа), во второй группе 69 (33,5 %) и в третьей 39 (19,2 %). [53]
Но пациенты с невус-ассоциированными и де-ново меланомами преимущественно принадлежали к одной возрастной группе. Средний возраст пациентов с невус-ассоциированными опухолями составил 52 года, а с опухолями де-ново – 57 лет. Поэтому более молодой возраст пациентов с невус-ассоциированными меланомами вряд ли можно объяснить меньшим количеством невусов.
Заключение
В ходе метаанализа Рикардо Пампена и коллеги установили, что менее трети меланом развиваются на фоне невусов. При этом невус-ассоциированные меланомы имеют меньшую толщину по Бреслоу по сравнению с меланомами де-ново. Меланомы возникают с практически одинаковой частотой в диспластических и типичных невусах.
Записаться на приёмREFERENCES
1. Whiteman DC, Pavan WJ, Bastian BC. The melanomas: a synthesis of epidemiological, clinical, histopathological, genetic, and biological aspects, supporting distinct suptypes, causal pathways, and cells of origin. Pigment Cell Melanoma Res. 2011; 24(5):879-897.
2. Lin WM, Luo S, Muzikansky A, et al. Outcome of patients with de novo versus nevus-associated melanoma. J Am Acad Dermatol. 2015; 72(1):54-58.
3. Kaddu S, Smolle J, Zenahlik P, et al. Melanoma with benign melanocytic naevus components: reappraisal of clinicopathological features and prognosis. Melanoma Res. 2002; 12(3):271-278.
4. Bevona C, Goggins W, Quinn T, et al. Cutaneous melanomas associated with nevi. Arch Dermatol. 2003; 139(12):1620-1624.
5. Ackerman LV. Malignant melanoma of the skin; clinical and pathologic analysis of 75 cases. Am J Clin Pathol. 1948; 18(8):602-624.
6. Couperus M, Rucker RC. Histopathological diagnosis of malignant melanoma. AMA Arch Derm Syphilol. 1954; 70(2):199-216.
7. Kashani-Sabet M, Rangel J, Torabian S, et al. A multi-marker assay to distinguish malignant melanomas from benign nevi. Proc Natl Acad Sci U S A. 2009; 106(15):6268-6272.
8. Rhodes AR, Sober AJ, Day CL, et al. The malignant potential of small congenital nevocellular nevi. An estimate of association based on a histologic study of 234 primary cutaneous melanomas. J Am Acad Dermatol. 1982; 6(2):230-241.
9. Rhodes AR, Harrist TJ, Day CL, et al. Dysplastic melanocytic nevi in histologic association with 234 primary cutaneous melanomas. J Am Acad Dermatol. 1983; 9(4):563-574.
10. Clark WH Jr, Elder DE, Guerry D, et al. A study of tumor progression: the precursor lesions of superficial spreading and nodular melanoma. Hum Pathol. 1984; 15(12):1147-1165.
11. Friedman RJ, Rigel DS, Kopf AW, et al. Favorable prognosis for malignant melanomas associated with acquiredmelanocytic nevi. Arch Dermatol. 1983; 119(6):455-462.
12. Balch CM, Gershenwald JE, Soong SJ, et al. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol. 2009; 27(36):6199-6206.
13. Longo C, Rito C, Beretti F, et al. De novo melanoma and melanoma arising from pre-existing nevus: in vivo morphologic differences as evaluated by confocal microscopy. J Am Acad Dermatol. 2011; 65(3):604-614.
14. Wells G, Shea B, O’Connell D, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa, ON: Ottawa Hospital Research Institute; 2011. Available at: http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp. Accessed February 5, 2013.
15. Krengel S, Hauschild A, Schafer T. Melanoma risk in congenital melanocytic naevi: a systematic review. Br J Dermatol. 2006; 155(1):1-8.
16. Moscarella E, Piccolo V, Argenziano G, et al. Problematic lesions in children. Dermatol Clin. 2013; 31(4):535-547. vii.
17. Tierney J, Stewart L, Ghersi D, et al. Practical methods for incorporating summary time-to-event data into meta-analysis. Trials. 2007; 8:16.
18. Higgins JPT, Green S, eds. Cochrane handbook for systematic reviews of interventions version 5.1.0. The Cochrane Collaboration; 2011. Available at: www.handbook.cochrance.org. Accessed March 2011.
19. Stolz W, Schmoeckel C, Landthaler M, et al. Association of early malignant melanoma with nevocytic nevi. Cancer. 1989; 63(3):550-555.
20. Massi D, Carli P, Franchi A, et al. Naevus-associated melanomas: cause or chance? Melanoma Res. 1999; 9(1):85-91.
21. Cymerman RM, Shao Y, Wang K, et al. De novo vs nevus-associated melanomas: differences in associations with prognostic indicators and survival. J Natl Cancer Inst. 2016; 108(10).
22. Cochran AJ. Histology and prognosis in malignant melanoma. J Pathol. 1969; 97(3):459-468.
23. Rigel DS, Rivers JK, Kopf AW, et al. Dysplastic nevi. Markers for increased risk for melanoma. Cancer. 1989; 63(2):386-389.
24. Betti R, Santambrogio R, Cerri A, et al. Observational study on the mitotic rate and other prognostic factors in cutaneous primary melanoma arising from naevi and from melanoma de novo. J Eur Acad Dermatol Venereol. 2014; 28(12):1738-1741.
25. Black WC. Residual dysplastic and other nevi in superficial spreading melanoma. Clinical correlations and association with sun damage. Cancer. 1988; 62(1):163-173.
26. Clark WH Jr, From L, Bernardino EA, et al. The histogenesis and biologic behavior of primary human malignant melanomas of the skin. Cancer Res. 1969; 29(3):705-727.
27. Crucioli V, Stilwell J. The histogenesis of malignant melanoma in relation to pre-existing pigmented lesions. J Cutan Pathol. 1982; 9(6):396-404.
28. Friedman RJ, Rigel DS, Heilman ER. The relationship between melanocytic nevi and malignant melanoma. Dermatol Clin. 1988; 6(2):249-256.
29. Gruber SB, Barnhill RL, Stenn KS, et al. Nevomelanocytic proliferations in association with cutaneous malignant melanoma: a multivariate analysis. J Am Acad Dermatol. 1989; 21(4 Pt 1):773-780.
30. Haenssle HA, Mograby N, Ngassa A, et al. Association of patient risk factors and frequency of nevus-associated cutaneous melanomas. JAMA Dermatol. 2016; 152(3):291-298.
31. Harley S, Walsh N. A new look at nevus-associated melanomas. Am J Dermatopathol. 1996; 18(2):137-141.
32. Hastrup N, Osterlind A, Drzewiecki KT, et al. The presence of dysplastic nevus remnants in malignant melanomas. A population-based study of 551 malignant melanomas. Am J Dermatopathol. 1991; 13(4):378-385.
33. Krüger S, Garbe C, Buttner P, et al. Epidemiologic evidence for the role of melanocytic nevi as risk markers and direct precursors of cutaneous malignant melanoma. Results of a case control study in melanoma patients and nonmelanoma control supjects. J Am Acad Dermatol. 1992; 26(6):920-926.
34. Larsen TE. The classification of primary cutaneous malignant melanoma. A prospective study of 60 cases using Clark’s classification. Acta Pathol Microbiol ScandA. 1978; 86A(5):451-459.
35. Marks R, Dorevitch AP, Mason G. Do all melanomas come from ‘‘moles’’? A study of the histological association between melanocytic naevi and melanoma. Australas J Dermatol. 1990; 31(2):77-80.
36. McGovern VJ, Shaw HM, Milton GW. Histogenesis of malignant melanoma with an adjacent component of the superficial spreading type. Pathology. 1985; 17(2):251-254.
37. McGovern VJ. The classification of melanoma and its relationship with prognosis. Pathology. 1970; 2(2):85-98.
38. Purdue MP, From L, Armstrong BK, et al. Etiologic and other factors predicting nevus-associated cutaneous malignant melanoma. Cancer Epidemiol Biomarkers Prev. 2005; 14(8):2015-2022.
39. Reddy KK, Farber MJ, Bhawan J, et al. Atypical (dysplastic) nevi: outcomes of surgical excision and association with melanoma. JAMA Dermatol. 2013; 149(8):928-934.
40. Sagebiel RW. Melanocytic nevi in histologic association with primary cutaneous melanoma of superficial spreading and nodular types: effect of tumor thickness. J Invest Dermatol. 1993; 100(3):322S-325S.
41. Shitara D, Nascimento MM, Puig S, et al. Nevus-associated melanomas: clinicopathologic features. Am J Clin Pathol. 2014; 142(4):485-491.
42. Søndergaard K. Histological type and biological behavior of primary cutaneous malignant melanoma. 1. An analysis of 1916 cases. Virchows Arch A Pathol Anat Histopathol. 1983; 401(3):315-331.
43. Stante M, Carli P, Massi D, et al. Dermoscopic features of naevus-associated melanoma. Clin Exp Dermatol. 2003; 28(5):476-480.
44. Skender-Kalnenas TM, English DR, Heenan PJ. Benign melanocytic lesions: risk markers or precursors of cutaneous melanoma? J Am Acad Dermatol. 1995; 33(6):1000-1007.
45. Urso C, Giannotti V, Reali UM, et al. Spatial association of melanocytic naevus and melanoma. Melanoma Res. 1991; 1(4):245-249.
46. Rippey JJ, Whiting DA. Moles and melanomas. Lancet. 1977; 2(8029):137.
47. Manganoni AM, Farisoglio C, Gavazzoni F, et al. Nodular melanomas associated with nevi. J Am Acad Dermatol. 2010; 63(5):e97.
48. Rigel DS, Friedman RJ, Kopf AW, et al. Precursors of malignant melanoma. Problems in computing the risk of malignant melanoma arising in dysplastic and congenital nevocytic nevi. Dermatol Clin. 1985; 3(2):361-365.
49. Kakavand H, Crainic O, Lum T, et al. Concordant BRAFV600E mutation status in primary melanomas and associated naevi: implications for mutation testing of primary melanomas. Pathology. 2014;46(3):193-198.
50. Tsao H, Bevona C, Goggins W, et al. The transformation rate of moles (melanocytic nevi) into cutaneous melanoma: a population-based estimate. Arch Dermatol. 2003; 139(3):282-288.
51. Zalaudek I, Catricala C, Moscarella E, et al. What dermoscopy tells us about nevogenesis. J Dermatol. 2011; 38(1):16-24.
52. Rosendahl CO, Grant-Kels JM, Que SK. Dysplastic nevus: fact and fiction. J Am Acad Dermatol. 2015; 73(3):507-512.
53. Zalaudek I, Grinschgl S, Argenziano G, et al. Age-related prevalence of dermoscopy patterns in acquired melanocytic naevi. Br J Dermatol. 2006; 154:299-304.
Другие статьи:
- Удаление родинок летом: опасно ли это?
- Как не сойти с ума, читая про меланому
- Изменения в родинке - симптом меланомы?
- Атипичные и диспластические невусы: нужно ли их удалять?
Полезная статья? Сделайте репост в Вашей социальной сети!

